Почему оптовым ветеринарным организациям важно обеспечить наличие актуальных документов системы качества?
С 01 сентября 2024 г. вступили в силу изменения в Постановление Правительства РФ от 31.03.2022 г. N547 «Об утверждении Положения о лицензировании фармацевтической деятельности», которые установили требования для организаций оптовой торговли лекарственными средствами для ветеринарного применения – соответствие их деятельности правилам надлежащей дистрибьюторской практики в рамках Евразийского экономического союза (Решение Совета Евразийской экономической комиссии от 03.11.2016 г. №80 «Об утверждении Правил надлежащей дистрибьюторской практики в рамках Евразийского экономического союза»).
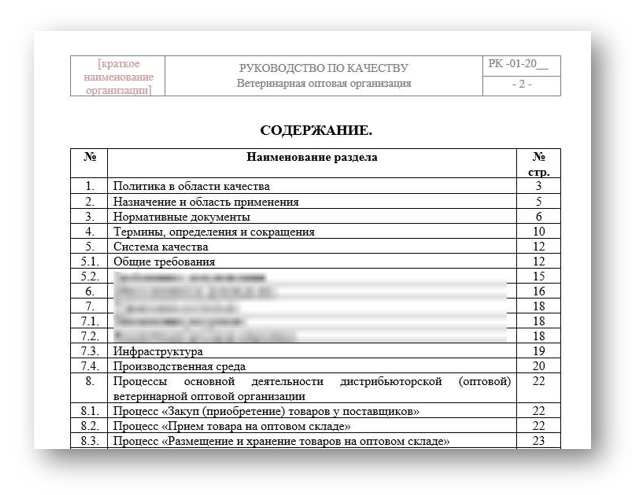
Основные требования
Одним из основных требований Правил надлежащей дистрибьюторской практики является разработка и внедрение внутренней документации (руководства качества, стандартных операционных процедур – СОП и других документов).
![]()
Важно! В 2025 году идут активные проверки оптовых ветеринарных организаций. Проверяющие выписывают предписания с требованием об оформлении документации системы качества в соответствии Решением СЕЭК от 03.11.2016 г. №80.
Ознакомьтесь! Выдержка из основных положений Решения СЕЭК от 03.11.2016 г. №80, где наши эксперты сопоставили ее с документами НДП Вет ОПТ . (см. Таблица документов системы качества НДП «ветеринария» в соответствии с Правилами надлежащей дистрибьюторской практики)
![]()
Какие последствия могут быть, если у оптовой ветеринарной организации не окажется актуальных документов НДП во время контрольных мероприятий?
В соответствии с ПП РФ от 31.03.2022 г. N547 осуществление деятельности без оформления документов качества НДП отнесено к грубым нарушениям.
| Административное наказание для юридических лиц при осуществлении предпринимательской деятельности с грубым нарушением требований и условий, предусмотренных специальным разрешением (лицензией), установлено ч. 4 ст. 14.1 КоАП РФ - штраф от 100 000 до 200 000 рублей или административное приостановление деятельности на срок до девяноста суток. |
Таким образом, за отсутствие, или ненадлежащее оформление документов системы качества НДП у оптовой ветеринарной организации, осуществляющей фармацевтическую деятельность, могут возникнуть серьёзные проблемы - от назначения крупного штрафа до полной приостановки деятельности всей организации.
Документация системы качества НДП для оптовой ветеринарной организации (в редакции Решения СЕЭК от 03.11.2016 г. №80):
![]() Содержит исчерпывающий перечень актуальных документов – 41 шаблон в формате MS Word.
Содержит исчерпывающий перечень актуальных документов – 41 шаблон в формате MS Word.
![]() В состав пакета документов входят: руководство по качеству, необходимый состав стандартных операционных процедур (СОП), приказы, методические и рабочие инструкции, документированные процедуры (полный перечень документов см. в реестре).
В состав пакета документов входят: руководство по качеству, необходимый состав стандартных операционных процедур (СОП), приказы, методические и рабочие инструкции, документированные процедуры (полный перечень документов см. в реестре).
![]() Помогает экономить время собственных специалистов на разработку и внедрение документации.
Помогает экономить время собственных специалистов на разработку и внедрение документации.
![]() Позволяет получать бесплатные консультации экспертов МедИнфо24 в момент внедрения документов НДП Вет ОПТ в Вашей организации.
Позволяет получать бесплатные консультации экспертов МедИнфо24 в момент внедрения документов НДП Вет ОПТ в Вашей организации.
Почему клиенты выбирают МедИнфо24 при внедрении документов системы качества на предприятии?

![]() Эксперты МедИнфо24 имеют большой практический опыт разработки шаблонов документов системы качества для фармацевтических организаций. Документы от экспертов МедИнфо24 зарекомендовали себя наилучшим образом во время контрольных мероприятий и позволяют избежать штрафных санкций контролирующих и надзорных органов.
Эксперты МедИнфо24 имеют большой практический опыт разработки шаблонов документов системы качества для фармацевтических организаций. Документы от экспертов МедИнфо24 зарекомендовали себя наилучшим образом во время контрольных мероприятий и позволяют избежать штрафных санкций контролирующих и надзорных органов.
![]()
При разработке документации использованы принципы стандартов ISO 9000 «Системы менеджмента качества (СМК). Основные положения и словарь», ISO 9001 «СМК. Требования», ISO 9004 «СМК. Рекомендации по улучшению деятельности», ISO 19011 «Руководящие указания по аудиту систем менеджмента», ISO 10013 «Руководство по документированию СМК».
![]()
Таблица документов системы качества НДП «ветеринария» в соответствии с Правилами надлежащей дистрибьюторской практики
| Пункт Решения №80 (НДП) | Требуемая документация | Документация СК, действия |
|---|---|---|
| п. 5 | 5. Дистрибьюторы создают и поддерживают систему качества, определяющую обязанности, процессы и принципы управления рисками в отношении осуществляемой ими деятельности. Все действия, связанные с дистрибьюцией, должны быть однозначно определены и проанализированы. Ключевые этапы процесса оптовой реализации (включая наиболее значимые изменения) должны быть обоснованы и при необходимости валидированы. Ответственность за функционирование системы качества несет руководитель организации. Персонал организации должен надлежащим образом исполнять обязанности, связанные с функционированием системы качества. | Документы системы качества в соответствии с реестром |
| п. 7 | 7. Система качества должна быть полностью документирована, ее эффективность должна подвергаться мониторингу и анализу. Действия персонала, относящиеся к системе качества, должны быть описаны в соответствующих письменных процедурах. Необходимо внедрить и поддерживать в актуальном состоянии руководство по качеству. | 1.1 Руководство по качеству |
| п. 8 | 8. Руководством организации назначается ответственное лицо, наделенное полномочиями и обязанностями для обеспечения внедрения и поддержания в актуальном состоянии системы качества. | 1.3 Приказ «О разработке и внедрении системы качества в подразделениях ветеринарной оптовой организации» п. 2 |
| п. 9 | 9. При создании, поддержании или изменении системы качества необходимо учитывать организационную структуру, объем выполняемых работ и услуг и многоплановость деятельности дистрибьютора. | 1.1 Руководство по качеству Приложение №1 |
| п. 10 | 10. У дистрибьютора должна быть внедрена система управления изменениями, которая должна быть пропорциональной и эффективной, а также основанной на принципах управления рисками для качества. | 1.13 СОП «Управление рисками для качества и контроль изменений документов системы качества» |
| п. 11 | 11. Система качества должна гарантировать следующее: а) лекарственные средства приобретаются, хранятся, транспортируются, поставляются или экспортируются с соблюдением требований настоящих Правил; б) обязанности руководства организации четко определены; в) лекарственные средства доставляются надлежащим получателям в согласованный период времени; г) документальное оформление действий осуществляется в ходе выполнения или непосредственно после завершения соответствующих действий; д) отклонения от установленных процедур документально оформляются и в их отношении проводятся расследования; е) необходимые корректирующие и предупреждающие действия предпринимаются для устранения отклонений и предупреждения их появления в соответствии с принципами управления рисками для качества. | а) Документы процессов основной деятельности (раздел II Процессы основной деятельности Реестра); б) 1.1 Руководство по качеству п. 6 Ответственность руководства; г) Договора на поставку и отпуск ЛП, приходные документы, ТТН и прочие документы в процессе работы; д) 1.15 Журнал внутреннего контроля качества; е) 1.12 СОП «Порядок осуществления внутреннего контроля и анализа его эффективности» |
| п. 12 | 12. Система качества включает в себя контроль и анализ деятельности, переданной на аутсорсинг и относящейся к приобретению, хранению, транспортировке, поставке или экспорту. Деятельность по аутсорсингу должна учитывать возможные риски для качества и содержать: а) оценку пригодности и компетентности исполнителя выполнить обязательства по договору должным образом, а также проверку наличия у исполнителя необходимых разрешительных документов в соответствии с законодательством государств-членов; б) определение ответственности, порядка взаимодействия сторон и обмена информацией о действиях в рамках мероприятий, относящихся к качеству; в) мониторинг и анализ деятельности исполнителя, а также определение и внедрение на регулярной основе мер, необходимых для улучшения. | Если есть работы, переданные другим организациям: 2.15 СОП «Порядок организации работ по аутсорсингу» |
| п. 13 | 13. Руководство организации должно установить формализованный процесс периодического обзора системы качества. Обзор должен включать в себя: а) оценку степени достижения целей системы качества; б) оценку показателей эффективности, которые могут быть использованы для мониторинга эффективности таких процессов системы качества, как количество претензий, отклонений от установленных норм, эффективность корректирующих и предупреждающих действий, изменения в процессах, отзывы о деятельности по аутсорсингу, процессы самопроверки (включая анализ рисков и аудиты), результаты внешнего контроля (включая инспекции и аудиты), выявленные несоответствия, аудиты клиентов; в) изменения, внесенные в нормативные правовые акты, руководства, а также возникновение новых обстоятельств, связанных с качеством, которые могут оказать влияние на систему управления качеством; г) инновации, которые могут повысить эффективность системы качества; д) изменения в деловой среде и поставленных целях. | б-в) 1.12 СОП «Порядок осуществления внутреннего контроля и анализа его эффективности»; 1.13 СОП «Управление рисками для качества и контроль изменений документов системы качества»; в) 1.4 Документированная процедура «Управление документацией»; 1.11 Документированная процедура «Управление несоответствиями» |
| п. 14 | 14. Результаты обзора системы качества со стороны руководства должны быть своевременно документально оформлены и доведены до сведения персонала. | Журнал результатов проведения первичной и последующей подготовки персонала; В оригиналах СОП- последний раздел «Лист согласований и ознакомлений» -ФИО и подпись исполнителей |
| п. 16 | 16. Выполнение требований надлежащей дистрибьюторской практики зависит от человеческого фактора. Дистрибьютор должен иметь достаточное количество квалифицированного персонала для решения всех задач, за которые отвечает организация. Каждый работник должен знать и понимать требования надлежащей дистрибьюторской практики в части, касающейся его деятельности. Каждый работник должен понимать индивидуальную ответственность, которая должна быть документирована. | ПП №547; о) наличие у лицензиата работника (работников), заключившего с ним трудовой договор, деятельность которого непосредственно связана с оптовой торговлей лекарственными средствами для ветеринарного применения, их хранением и (или) розничной торговлей лекарственными препаратами для ветеринарного применения, их отпуском, хранением, перевозкой и изготовлением, имеющего высшее или среднее фармацевтическое образование, а также сертификат специалиста или пройденную аккредитацию специалиста либо высшее или среднее ветеринарное образование, а также сертификат специалиста; Журнал результатов проведения первичной и последующей подготовки персонала; Индивидуальная ответственность- должностные инструкции |
| п. 17 | 17. Руководством дистрибьютора должно быть назначено ответственное лицо. Ответственное лицо должно соответствовать квалификационным требованиям, установленным законодательством государства-члена, и обладать необходимой квалификацией (предпочтительно фармацевтическим образованием), опытом и знаниями в области надлежащей дистрибьюции. В отдельных случаях ответственное лицо может иметь нефармацевтическое образование, в том числе при дистрибьюции радиофармацевтических препаратов - образование в области радиобиологии, ядерной физики или радиофизики, при дистрибьюции медицинских газов - образование физико-технического профиля. Профиль образования ответственного лица должен быть установлен руководством по качеству дистрибьютора исходя из его номенклатуры товарных позиций лекарственных средств. | 1.3 Приказ «О разработке и внедрении системы качества в подразделениях ветеринарной оптовой организации» п. 2 [назначение]. 1.1 Руководство по качеству п. 6 Ответственность руководства [обязанности] |
| п. 19 | 19. Полномочия ответственного лица по принятию решений в рамках своих должностных обязанностей, а также необходимые ресурсы для их выполнения должны быть определены должностной инструкцией. Ответственное лицо должно быть наделено четко определенными полномочиями, ресурсами и зонами ответственности, необходимыми для выполнения возложенных на него обязанностей. | Должностная инструкция |
| п. 20 | 20. Ответственное лицо должно выполнять свои обязанности таким образом, чтобы дистрибьютор мог подтвердить соблюдение надлежащей дистрибьюторской практики. | Документы СК в соответствии и реестром. 1.12 СОП «Порядок осуществления внутреннего контроля и анализа его эффективности» |
| п. 21 | 21. К обязанностям ответственного лица относятся: а) обеспечение внедрения и поддержания системы управления качеством; б) концентрация на управлении установленной деятельностью и на обеспечении точности и качества записей; в) обеспечение внедрения и поддержания программ первичного и последующего обучения для всего персонала, вовлеченного в процесс дистрибьюции; г) координирование и своевременная организация отзыва лекарственных средств из обращения; д) обеспечение эффективной работы с претензиями покупателей (получателей); е) утверждение поставщиков и получателей; ж) утверждение передачи на аутсорсинг деятельности, потенциально влияющей на соблюдение надлежащей дистрибьюторской практики; з) обеспечение проведения самоинспекций в соответствии с установленной периодичностью и подготовленной программой, а также принятия необходимых корректирующих мер; и) хранение необходимых записей, относящихся к делегированным обязанностям; к) принятие решений относительно возвращенных, отозванных, отклоненных, признанных недоброкачественными, фальсифицированных лекарственных средств; л) одобрение возвращения лекарственных средств в категорию пригодных для реализации; м) обеспечение соблюдения любых дополнительных требований, установленных в отношении определенной продукции законодательством государств-членов. | а) Приказ «О разработке и внедрении системы качества в подразделениях ветеринарной оптовой организации» (Приложение «План развития системы качества»); б) 1.5 Документированная процедура «Управление записями»; в) 3.9 Приказ «Об утверждении плана-графика первичной и последующей подготовки (инструктажа) персонала»; г,к) 1.9 СОП «Порядок организации работы с информацией о приостановлении реализации, отзыве и изъятии из обращения лекарственных препаратов, незарегистрированных медицинских изделий и забракованных БАД»; д) 2.10 Приказ «Об утверждении порядка оценки потребителей товаров» (с Приложением «Критерии и порядок оценки потребителей»); 2.11 СОП «Порядок оценки потребителей товаров»; ж) СОП «Порядок организации работ по аутсорсингу»; з) 1.6 Приказ «Об утверждении положения о внутреннем аудите» (вместе с Приложением «Положение о проведении внутреннего аудита»); 1.7 Документированная процедура «Внутренний аудит»; и) 1.5 Документированная процедура «Управление документацией» Приложение №1; л) 2.4 СОП «Порядок организации работ при проведении приемочного контроля товаров на оптовом складе ветеринарной оптовой организации» п. 4 |
| п. 23 | 23. Организационная структура дистрибьютора оформляется в виде схемы и утверждается руководителем. Функции, обязанности и взаимодействие работников должны быть четко обозначены. | 1.1 Руководство по качеству Приложение №1 |
| п. 25 | 25. Все работники, вовлеченные в деятельность по дистрибьюции лекарственных средств, должны пройти обучение по вопросам, касающимся надлежащей дистрибьюторской практики, иметь необходимую квалификацию до начала выполнения своих должностных обязанностей. Работники должны проходить первичное и последующее обучение в соответствии с выполняемыми ими обязанностями на основании письменно оформленных процедур и программы обучения. Ответственное лицо должно поддерживать компетентность персонала в области надлежащей дистрибьюторской практики посредством регулярного обучения. Дополнительно обучение должно включать аспекты идентификации продукции и предотвращения попадания в цепь поставки фальсифицированных лекарственных средств. | 3.9 Приказ «Об утверждении плана-графика первичной и последующей подготовки (инструктажа) персонала»; 3.10 Приложение №1 к приказу «Об утверждении плана-графика первичной и последующей подготовки (инструктажа) персонала» - План-график первичной и последующей подготовки (инструктажа) работников на 20__г |
| п. 28 | 28. Должны быть установлены и должны соблюдаться соответствующие процедуры по гигиене труда и личной гигиене работников, применимые к осуществляемой деятельности. Эти процедуры должны включать требования, относящиеся к здоровью, |
Остались вопросы?
Наши сотрудники будут рады ответить на любые вопросы по телефону +7(499)938-95-24, а также по адресу support@medinfo24.ru
Какой сборник СОП выбрать для розничных аптек?
Уважаемые коллеги! Сегодня мы разберём самый популярный запрос от наших клиентов — «Мне нужны СОПы для аптеки» и поможем выбрать подходящий сборник на сайте МедИнфо24. Перед принятием решения необходимо разобраться...
Какие купить СОПы для ветеринарной аптеки?
Уважаемые руководители ветеринарных аптек! Сегодня разберем тему приобретения СОПов, а также других документов качества для ветеринарных аптек в соответствии с вопросами, которые поступают от наших клиентов при выборе документов. На...
Как открыть аптеку с нуля в 2025 году? 7 основных шагов от экспертов
Почему аптеки так популярны и их открывают практически на каждом углу? Всё дело в том, что при любом заболевании - будь то насморк или сыпь, все бегут за лекарствами. На...

