Маркировка лекарственных препаратов
Начиная с 2017 года требования к обороту лекарственных препаратов постепенно ужесточались, и в 2020 году в России был принят закон об обязательной маркировке всех лекарств, производимых и реализуемых на территории страны. Как в настоящий момент регистрируются препараты? Приводим пошаговую инструкцию для различных участников рынка.
О чём эта статья:1. Законодательная основа маркировки. 2. Сроки. 3. Участники фармацевтического рынка: 4. Схема маркирования. 5. Что представляет собой код маркировки? 6. Ответственность участников рынка. 7. Процесс регистрации в системе маркировки. 8. Дистрибьюторам. 9. Стоматологиям и медицинским центрам: |
Законодательная основа для обязательной маркировки
В Российской Федерации контроль над оборотом лекарственных препаратов осуществляется на законодательном уровне. Обязательная маркировка лекарств проводится в соответствии с Федеральными законами № 61-ФЗ от 12.04.2010 «Об обращении лекарственных средств», № 462-ФЗ от 27.12.2019 «О внесении изменений в Федеральный закон «Об обращении лекарственных средств» и Федеральный закон «О внесении изменений в Федеральный закон «Об обращении лекарственных средств» (о маркировании высокозатратных нозологий), Постановлением Правительства РФ от 14.12.2018 № 1556 «Об утверждении Положения о системе мониторинга движения лекарственных препаратов для медицинского применения».

Сроки
С 01 июля 2019 г., согласно Постановлению от 14.12.2018 № 1557 «Об особенностях внедрения системы мониторинга движения лекарственных препаратов для медицинского применения», производители и продавцы фармацевтической отрасли Российской Федерации должны проходить регистрацию в системе «Честный знак» на официальном одноимённом сайте. С 01 октября 2019 года введены обязательства маркировать лекарства из списка высокозатратных нозологий.
Обязательная маркировка лекарственных препаратов всех форм и наименований введена с 01 июля 2020 года в соответствии с тем же Постановлением.

Участники фармацевтического рынка
Оборот лекарственных препаратов на территории России строго контролируется. Все производители, дистрибьюторы, продавцы (аптеки) и прямые потребители, получающие препараты по контрактам (например, стоматологии, поликлиники и т. д.), регистрируются в единой системе МДЛП, где каждый из участников занимает свою нишу. Из-за жёсткого мониторинга внедрение в данную иерархию несанкционированных компаний весьма затруднено.
Участники рынка обязаны учитывать маркировку продукции, однако делают это в пределах своей компетенции и в установленном порядке. Работа по регистрации препаратов и их перемещению осуществляется онлайн только зарегистрированными в системе пользователями. В постановлениях № 1556 и № 1557 подробно перечислены обязанности и алгоритм действия участников фармацевтического рынка РФ.
Производители
Первыми наносят маркировку (код) на упаковку при изготовлении лекарств, при этом обязательно регистрируют новый препарат на сайте МДЛП как впервые вводимый в обращение.
Дистрибьюторы
Логистические комплексы и дистрибьюторские компании, которые производят расформирование оптовых партий лекарств, фармацевтическую продукцию не маркируют, но отчитываются о движении товаров, направляя информацию в систему МДЛП: при получении лекарственных препаратов на склад, при расформировании оптовых упаковок, при отгрузке товаров со склада.
Аптеки
Направляют данные о прибытии лекарственных препаратов на аптечный склад и об их оприходовании. А также отчитываются о приобретении препаратов через онлайн-кассу и при выбытии товаров из оборота с указанием причины.
Регламентированные причины выбытия препаратов из оборота – это реализация, утеря (недостача), списание бракованных товаров, частичное списание недоукомплектованных упаковок или товаров, утилизация, списание товаров без утилизации.
Медицинские центры
Направляют отчёт в систему МДЛП при приёме лекарственных препаратов на склад, при внутреннем движении (например, со склада в отделение), при списании по причине оказания медицинских услуг (прямое применение лекарств в условиях стационара), при выбытии из обращения с указанием причин.

Схема маркирования
В среде российских поставщиков и производителей лекарств действует обратная система маркировки. По данной схеме коды товаров направляет аптека, а не дистрибьюторская компания. Дистрибьютор лишь получает их от производителя, который изготавливает и маркирует товары, и осуществляет дальнейшее передвижение в розничную сеть. Аптека, в свою очередь, считывает коды с упаковок и переправляет в систему, после чего поставщик подтверждает их соответствие.
Выбытие кода из обращения происходит при реализации или по иным причинам. Провизор в аптеке сканирует упаковку, продавая товар покупателю, и проводит через кассу. Оператор фискальных данных направляет информацию о реализованном препарате в систему. Таким образом, код проданного товара удаляется из обращения.

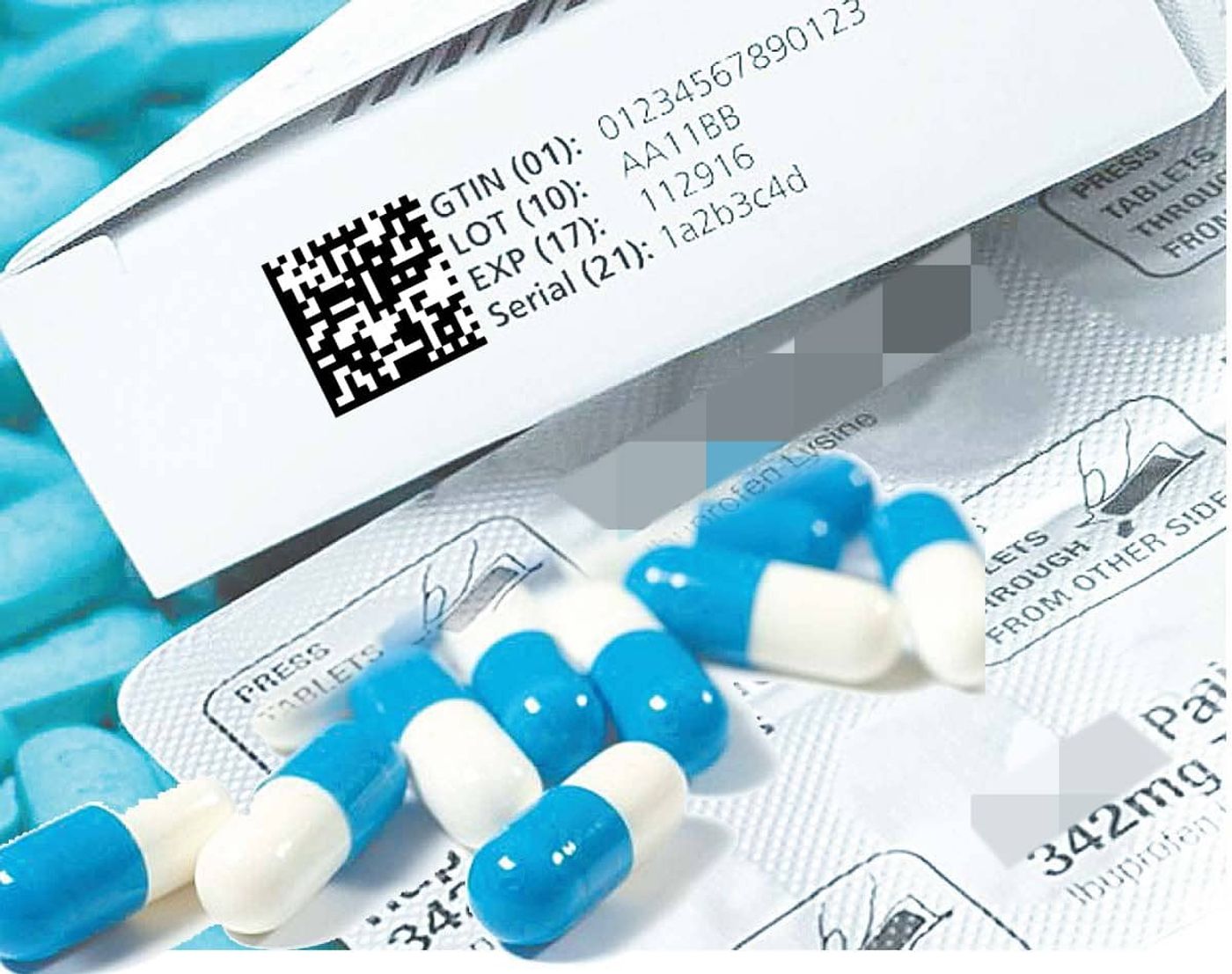
Что представляет собой код маркировки?
При маркировке лекарств используется электронно-цифровой формат Data Matrix, когда каждой упаковке присваивается двумерный код длиной в 83 символа. Специфическая структура и неповторимые комбинации знаков исключают подделки и имитации. Если в торговую сеть поступает контрафакт, система тут же распознаёт поддельное лекарство по неправильному коду и сообщает об этом. По этой причине нельзя в процессе реализации заменить какой-либо препарат таким же препаратом из другой партии, или аналогом другого бренда.
Data Matrix содержит следующие обозначения:
- «01» плюс 14 знаков – международная кодировка;
- «21» плюс 13 знаков – серийный номер продукции (генерирует оператор системы);
- «91» плюс 4 знака – проверочный ключ;
- «92» плюс 44 знака − проверочный код.
Размер маркировки на упаковке может быть разным. Чаще всего это габариты 16х16 мм, но встречаются и коды 10х10 и 12х12 мм. При формировании укрупнённых партий на поддонах, паллетах, в коробках используют кодировку GS1 128. При наведении сканера такая маркировка показывает сведения обо всех лекарственных препаратах и их количестве в упакованной таре.

Ответственность участников рынка
Нарушение законодательства в процессе производства и продажи лекарственных препаратов, а также допуск препаратов в торговую сеть без обязательной маркировки влечёт административную и уголовную ответственность.
Если общая стоимость немаркированных товаров, допущенных в оборот, составляет менее 1 500 000 рублей, то ответственное лицо наказывается денежным штрафом:
- индивидуальные предприниматели − 5−10 тысяч рублей;
- юрлица − 50−300 тысяч рублей.
Уголовному преследованию подвергаются недобросовестные и несанкционированные участники рынка, которые допустили к реализации немаркированные контрафактные или поддельные лекарства на сумму более 1 500 000 рублей. Согласно законодательству Российской Федерации, ответственное лицо ждёт реальный тюремный срок до 3 лет и штраф в размере 80 тысяч рублей.
С полным перечнем нарушений и санкций можно ознакомиться на сайте «Честный знак».

Процесс регистрации в системе маркировки
Юрлицам и индивидуальным предпринимателям для регистрации требуется усиленная ЭЦП (электронно-цифровая подпись). Для работы в системе следует установить плагин «КриптоПро» и СКЗИ с подтверждённым сертификатом. При открытии диалогового окна необходимо указать данные сертификата УКЭП, при этом информация о пользователе загрузится автоматически. Затем нужно добавить данные лицензии и закончить регистрацию, поставив ЭЦП. Ваше заявление будет рассмотрено в течение 10 рабочих дней.

Аптекам
Что требуется для маркировки
Прежде всего − присоединение к системе маркировки для отправки кодов. Затем нужно обновить приложение онлайн-кассы, для того чтобы прикреплять коды к чекам, и подключить к кассе систему ОФД, чтобы автоматизировать процесс передачи чека с кодом в систему маркировки. Необходимо также приобрести и настроить сканеры для считывания кодов с упаковок на складе и в торговом зале.
Приёмка препаратов
При приёмке поступающие в аптеку лекарства сканируются, а затем направляются поставщику и в систему МДЛП для фиксирования и подтверждения.
Продажа товаров в розницу
Продажа лекарств через онлайн-кассу осуществляется путём сканирования кода с упаковки, после чего сведения добавляются в чек. После проведения оплаты данные о проданном товаре автоматически направляются в систему маркировки.

Дистрибьюторам
Учитывая обратный порядок маркировки, дистрибьюторским компаниям следует лишь сделать подтверждение кодов, полученных от аптек.

Стоматологиям и медицинским центрам
Что необходимо для маркировки
Медицинским организациям требуется подключиться к системе МДЛП, приобрести сканирующее 2D-устройство для считывания кодов при приёмке на склад, а также потребуется регистратор выбытия для учёта лекарств, использованных по назначению для лечения пациентов.

Приёмка
Так же, как в аптеках: при приёме препаратов нужно сканировать упаковки и направлять коды в систему МДЛП и дистрибьютору для подтверждения.

Где взять регистратор выбытия?
Сначала следует оформить заявку на сайте «ЧестныйЗнак» через меню «Личного кабинета», а затем подписать договор согласно инструкции. Регистратор выбытия предоставляется организациям безвозмездно.

Списание
Списание товаров проводится через регистратор выбытия. Для этого следует считать код на упаковке в момент выдачи пациенту, а затем направить его в систему маркировки.
Таким образом, обязательная маркировка лекарств осуществляется один раз, в момент производства препаратов. Присвоенный заводом-изготовителем код является эффективным инструментом контроля движения товара от производителя к конечному потребителю, а также гарантией качества и оригинальности лекарственного препарата.

NB!
Коллеги, так же обратите внимание на документы прикрепленные к этой статье.
Вы можете, как оформить конкретный недостающий документ, так и комплексно обновить докуметацию, СОПы и другую рабочую документацию для фармацевтической организации с учетом последних изменений в законодательстве.

Задайте свой вопрос экспертам МедИнфо24 там, где вам удобно:
Какие купить СОПы для ветеринарной аптеки?
Уважаемые руководители ветеринарных аптек! Сегодня разберем тему приобретения СОПов, а также других документов качества для ветеринарных аптек в соответствии с вопросами, которые поступают от наших клиентов при выборе документов. На...
Документы системы качества для оптовых ветеринарных организаций
Почему оптовым ветеринарным организациям важно обеспечить наличие актуальных документов системы качества? С 01 сентября 2024 г. вступили в силу изменения в Постановление Правительства РФ от 31.03.2022 г. N547 «Об утверждении...
Как открыть аптеку с нуля в 2025 году? 7 основных шагов от экспертов
Почему аптеки так популярны и их открывают практически на каждом углу? Всё дело в том, что при любом заболевании - будь то насморк или сыпь, все бегут за лекарствами. На...